SMANSA BANJAR BARU
tulang bawang
Selasa, 06 Juni 2017
Jumat, 03 Februari 2017
Contoh soal jenis atom Karbon dan pembahasannya
Jenis atom karbon ada 4 yaitu:
Nomor 1
Jumlah atom C primer senyawa dibawah ini adalah...
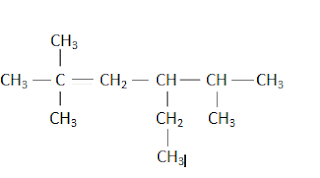
A 1
B. 2
C.4
D.6
E.8
Pembahasan
Jumlah atom primer senyawa itu ada 6:

Jawaban: D
Nomor 2
Jumlah atom C sekunder senyawa seperti gambar nomor 1 adalah....
A. 2
B. 3
C. 4
D. 5
E. 6
Pembahasan
Jumlah atom C sekunder senyawa tersebut adalah 2:

Jawaban: A
Nomor 3
Jumlah atom tersier senyawa dibawah ini adalah...

A. 5
B. 4
C. 3
D. 2
E. 1
Pembahasan
Jumlah atom C tersier senyawa tersebut adalah 1:

Jawaban: E
Nomor 4
Jumlah atom C kuarterner senyawa seperti gambar nomor 3 adalah...
A. 2
B. 4
C. 5
D. 6
E. 8
Pembahasan
Jumlah atom C kuarterner adalah 2:

Jawaban: A
- Atom C Primer: Atom C yang hanya mengikat satu atom C lainnya.
- Atom C Sekunder: Atom C yang mengikat dua atom C lainnya.
- Atom C tersier: Atom C yang mengikat tiga atom C lainnya.
- Atom C kuarterner: Atom C yang mengikat empat atom C lainnya.
Nomor 1
Jumlah atom C primer senyawa dibawah ini adalah...

A 1
B. 2
C.4
D.6
E.8
Pembahasan
Jumlah atom primer senyawa itu ada 6:

Jawaban: D
Nomor 2
Jumlah atom C sekunder senyawa seperti gambar nomor 1 adalah....
A. 2
B. 3
C. 4
D. 5
E. 6
Pembahasan
Jumlah atom C sekunder senyawa tersebut adalah 2:

Jawaban: A
Nomor 3
Jumlah atom tersier senyawa dibawah ini adalah...

A. 5
B. 4
C. 3
D. 2
E. 1
Pembahasan
Jumlah atom C tersier senyawa tersebut adalah 1:

Jawaban: E
Nomor 4
Jumlah atom C kuarterner senyawa seperti gambar nomor 3 adalah...
A. 2
B. 4
C. 5
D. 6
E. 8
Pembahasan
Jumlah atom C kuarterner adalah 2:

Jawaban: A
Label:
Jenis atom karbon,
Kimia SMA
Lokasi:
Indonesia
Rabu, 01 Februari 2017
Permendikbud No. 3 Tahun 2017 tetang Penilaian Hasil Belajar
Permendikbud No. 3 Tahun 2017 tetang Penilaian Hasil Belajar
Blog Ilmu Matematika
http://ilmu-matematika.blogspot.com
Selasa, 31 Januari 2017
Pembahasan contoh soal rumus molekul kimia SMA
Nomor 1
Diketahui pembakaran 0,55 gram senyawa karbon (mengandung C, H, O) dihasilkan 1,32 gram CO2 dan 0,54 H2O. Jika Mr = 110 maka rumus molekul senyawa tersebut adalah.... (Ar C = 12, Ar H = 1, Ar O = 16)
A. CHO
B. C3H3O
C. C3H3O3
D. C6H6O2
E. C6H6O3
Pembahasan
Misal senyawa karbon tersebut : CxHyOz
Hitung massa C, H dan O
massa C = massa C dalam CO2 = (Ar C / Mr CO2) x massa CO2
massa C = (12 / 44) x 1,32 gram = 0,36 gram
massa H = massa H dalam H2O = (Ar H / Mr H2O) x massa H2O
massa H = (1 / 18) x 0,54 gram = 0,03 gram
massa O = massa CxHyOz - massa C - massa H
massa O = 0,55 gram - 0,36 gram - 0,03 gram = 0,16
Hitung perbandingan mol C, H, O
nC : nH : nO = (0,36 / 12) : (0,03 / 1) : (0,16 / 16) = 0,03 : 0,03 : 0,01
nC : nH : nO = 3 : 3 : 1
Rumus empiris senyawa = C3H3O
Rumus molekul
Mr(C3H3O) = (3bAr C + 3 Ar H + Ar O)n
110 = (3 . 12 + 3 . 1 + 16)n
110 = (36 + 3 + 16)n
110 = 55n
n = 110 / 55 = 2
Jadi rumus molekul = (C3H3O)2 = C6H6O2
Jawaban: D
Nomor 2
Suatu senyawa tersusun dari 48 % Karbon, 20 % Hidrogen dan 32 % Oksigen. Jika Mr = 150 maka rumus molekul senyawa tersebut adalah .... (Ar C = 12, H = 1, O = 16)
A. C3H6O2
B. C6H12O3
C. C6H30O3
D. C8H30O6
E. C10H30O10
Pembahasan
Misalkan senyawa tersebut CxHyOz
Hitung perbandingan mol C, H, O:
nC : nH : nO = (48 / 12) : (20 / 1) : (32 / 16) = 4 : 20 : 2 = 2 : 10 : 1
Jadi rumus empiris senyawa = C2H10O
Menghitung rumus molekul senyawa
Mr (C2H10O) = (2 Ar C + 10 Ar H + Ar O)n
150 = (24 + 10 + 16) n
150 = 50 n
n = 150 / 50 = 3
Jadi rumus molekul senyawa = (C2H10O) 3 = C6H30O3
Jawaban: C
Diketahui pembakaran 0,55 gram senyawa karbon (mengandung C, H, O) dihasilkan 1,32 gram CO2 dan 0,54 H2O. Jika Mr = 110 maka rumus molekul senyawa tersebut adalah.... (Ar C = 12, Ar H = 1, Ar O = 16)
A. CHO
B. C3H3O
C. C3H3O3
D. C6H6O2
E. C6H6O3
Pembahasan
Misal senyawa karbon tersebut : CxHyOz
Hitung massa C, H dan O
massa C = massa C dalam CO2 = (Ar C / Mr CO2) x massa CO2
massa C = (12 / 44) x 1,32 gram = 0,36 gram
massa H = massa H dalam H2O = (Ar H / Mr H2O) x massa H2O
massa H = (1 / 18) x 0,54 gram = 0,03 gram
massa O = massa CxHyOz - massa C - massa H
massa O = 0,55 gram - 0,36 gram - 0,03 gram = 0,16
Hitung perbandingan mol C, H, O
nC : nH : nO = (0,36 / 12) : (0,03 / 1) : (0,16 / 16) = 0,03 : 0,03 : 0,01
nC : nH : nO = 3 : 3 : 1
Rumus empiris senyawa = C3H3O
Rumus molekul
Mr(C3H3O) = (3bAr C + 3 Ar H + Ar O)n
110 = (3 . 12 + 3 . 1 + 16)n
110 = (36 + 3 + 16)n
110 = 55n
n = 110 / 55 = 2
Jadi rumus molekul = (C3H3O)2 = C6H6O2
Jawaban: D
Nomor 2
Suatu senyawa tersusun dari 48 % Karbon, 20 % Hidrogen dan 32 % Oksigen. Jika Mr = 150 maka rumus molekul senyawa tersebut adalah .... (Ar C = 12, H = 1, O = 16)
A. C3H6O2
B. C6H12O3
C. C6H30O3
D. C8H30O6
E. C10H30O10
Pembahasan
Misalkan senyawa tersebut CxHyOz
Hitung perbandingan mol C, H, O:
nC : nH : nO = (48 / 12) : (20 / 1) : (32 / 16) = 4 : 20 : 2 = 2 : 10 : 1
Jadi rumus empiris senyawa = C2H10O
Menghitung rumus molekul senyawa
Mr (C2H10O) = (2 Ar C + 10 Ar H + Ar O)n
150 = (24 + 10 + 16) n
150 = 50 n
n = 150 / 50 = 3
Jadi rumus molekul senyawa = (C2H10O) 3 = C6H30O3
Jawaban: C
Label:
Kimia SMA,
Rumus molekul
Lokasi:
Indonesia
Senin, 30 Januari 2017
Pembahasan contoh soal rumus empiris senyawa Kimia SMA
Nomor 1
Diketahui senyawa hidrokarbon dengan 60 % karbon dan 40 % hidrogen. Jika massa hidrokarbon = 200 gram maka rumus empiris hidrokarbon tersebut adalah...(Mr C = 12 dan Mr H = 1)
A. CH2
B. CH4
C. CH8
D. C2H4
E. C4H8
Pembahasan
Terlebih dahulu misalkan senyawa karbon tersebut = Cx Hy
Menghitung massa karbon dan massa hidrogen
massa karbon = ( 60 / 100) x 200 gram = 120 gram.
massa hidrogen = (40 / 100) x 200 gram = 80 gram
Menentukan perbandingan mol masing-masing unsur
C : H = (gram C / Mr C) : (gram H / Mr H)
C : H = (120 / 12) : (80 / 1)
C : H = 10 : 80 = 1 : 8
Jadi rumus empiris senyawa hidrokarbon = CH8
Jawaban: C
Nomor 2
Diketahui pembakaran sempurna 26 gram suatu senyawa yang mengandung C, H dan O. Jika pembakaran menghasilkan 22 gram CO2 dan 36 gram H2O, maka rumus empiris senyawa tersebut adalah...(Ar C = 12, Ar O = 16, Ar H = 1)
A. CHO2
B. CH2O2
C. CH4O2
D. C2H2O4
E. C4H4O2
Pembahasan
Misalkan senyawa tersebut adalah Cx Hy Oz.
Hitung terlebih dahulu massa O2 yang bereaksi = (massa CO2 + massa H2O) - massa senyawa
massa O2 yang bereaksi = (22 gram + 36 gram) - 26 gram = 58 gram - 26 gram = 32 gram
Hitung massa C pada CxHyOz
massa C (CxHyOz) = massa C pada CO2 = (Ar C / Mr CO2) x gr CO2 =
massa C (CxHyOz) = (12 / 44) x 22 gram = 6 gram
Hitung massa H pada CxHyOz
massa H (CxHyOz) = massa H pada H2O = (Ar H / Mr H2O) x gram H2O
massa H (CxHyOz) = (1/18) x 36 gram = 2 gram
Hitung massa O pada CxHyOz
massa O (CxHyOz) = (massa O pada CO2 + massa O pada H2O) - massa O yang bereaksi
massa O (CxHyOz) = (16 gram + 34 gram) - 32 gram = 16 gram
Perbandingan x : y : z
x : y : z = mol C : mol H : mol O
x : y : z = (gr C / Ar C) : (gr H / Ar H) : (gr O / Ar O)
x : y : z = (6 / 12) : (2 / 1) : (16 / 16) = 0,5 : 2 : 1 = 1 : 4 : 2
Jadi rumus empiris = CH4O2
Jawaban: C
Nomor 3
Diketahui senyawa mengandung 54 gram aluminium dan 48 gram unsur oksigen. Rumus empiris senyawa tersebut adalah....(Ar Al = 27 dan Ar O = 16)
A. AlO
B. Al2O
C. Al2O2
D. Al2O3
E. Al3O3
Pembahasan
Misalkan senyawa tersebut AlxOy.
Hitung mol Al = gr Al / Ar = 54 / 27 = 2 mol
Hitung mol O = gr O / Ar O = 48 / 16 = 3 mol
Jadi;
x : y = 2 : 3
Sehingga rumus empiris = Al2O3
Jawaban: D
Diketahui senyawa hidrokarbon dengan 60 % karbon dan 40 % hidrogen. Jika massa hidrokarbon = 200 gram maka rumus empiris hidrokarbon tersebut adalah...(Mr C = 12 dan Mr H = 1)
A. CH2
B. CH4
C. CH8
D. C2H4
E. C4H8
Pembahasan
Terlebih dahulu misalkan senyawa karbon tersebut = Cx Hy
Menghitung massa karbon dan massa hidrogen
massa karbon = ( 60 / 100) x 200 gram = 120 gram.
massa hidrogen = (40 / 100) x 200 gram = 80 gram
Menentukan perbandingan mol masing-masing unsur
C : H = (gram C / Mr C) : (gram H / Mr H)
C : H = (120 / 12) : (80 / 1)
C : H = 10 : 80 = 1 : 8
Jadi rumus empiris senyawa hidrokarbon = CH8
Jawaban: C
Nomor 2
Diketahui pembakaran sempurna 26 gram suatu senyawa yang mengandung C, H dan O. Jika pembakaran menghasilkan 22 gram CO2 dan 36 gram H2O, maka rumus empiris senyawa tersebut adalah...(Ar C = 12, Ar O = 16, Ar H = 1)
A. CHO2
B. CH2O2
C. CH4O2
D. C2H2O4
E. C4H4O2
Pembahasan
Misalkan senyawa tersebut adalah Cx Hy Oz.
Hitung terlebih dahulu massa O2 yang bereaksi = (massa CO2 + massa H2O) - massa senyawa
massa O2 yang bereaksi = (22 gram + 36 gram) - 26 gram = 58 gram - 26 gram = 32 gram
Hitung massa C pada CxHyOz
massa C (CxHyOz) = massa C pada CO2 = (Ar C / Mr CO2) x gr CO2 =
massa C (CxHyOz) = (12 / 44) x 22 gram = 6 gram
Hitung massa H pada CxHyOz
massa H (CxHyOz) = massa H pada H2O = (Ar H / Mr H2O) x gram H2O
massa H (CxHyOz) = (1/18) x 36 gram = 2 gram
Hitung massa O pada CxHyOz
massa O (CxHyOz) = (massa O pada CO2 + massa O pada H2O) - massa O yang bereaksi
massa O (CxHyOz) = (16 gram + 34 gram) - 32 gram = 16 gram
Perbandingan x : y : z
x : y : z = mol C : mol H : mol O
x : y : z = (gr C / Ar C) : (gr H / Ar H) : (gr O / Ar O)
x : y : z = (6 / 12) : (2 / 1) : (16 / 16) = 0,5 : 2 : 1 = 1 : 4 : 2
Jadi rumus empiris = CH4O2
Jawaban: C
Nomor 3
Diketahui senyawa mengandung 54 gram aluminium dan 48 gram unsur oksigen. Rumus empiris senyawa tersebut adalah....(Ar Al = 27 dan Ar O = 16)
A. AlO
B. Al2O
C. Al2O2
D. Al2O3
E. Al3O3
Pembahasan
Misalkan senyawa tersebut AlxOy.
Hitung mol Al = gr Al / Ar = 54 / 27 = 2 mol
Hitung mol O = gr O / Ar O = 48 / 16 = 3 mol
Jadi;
x : y = 2 : 3
Sehingga rumus empiris = Al2O3
Jawaban: D
Label:
Kimia SMA,
Rumus empiris
Lokasi:
Indonesia
Jumat, 27 Januari 2017
"Bocoran" UN Matematika SMP 2017
"Bocoran" UN Matematika SMP 2017
Berikut ini Prediksi "Bocoran" UN Matematika SMP 2017:
Untuk soal silahkan di klik dibagian "Soal Matematika SMP 2017" dan untuk pembahasan klik di kata "Kunci Jawaban Matematika SMP 2017"
1. Paket 1 (Soal Matematika SMP 2017) + (Kunci Jawaban Matematika SMP 2017)
2. Paket 2 (Soal Matematika SMP 2017) + (Kunci Jawaban Matematika SMP 2017)
3. Paket 3 (Soal Matematika SMP 2017) + (Kunci Jawaban Matematika SMP 2017)
4. Paket 4 (Soal Matematika SMP 2017) + (Kunci Jawaban Matematika SMP 2017)
5. Paket 5 (Soal Matematika SMP 2017) + (Kunci Jawaban Matematika SMP 2017)
6. Paket 6 (Soal Matematika SMP 2017) + (Kunci Jawaban Matematika SMP 2017)
7. Paket 7 (Soal Matematika SMP 2017) + (Kunci Jawaban Matematika SMP 2017)
8. Paket 8 (Soal Matematika SMP 2017) + (Kunci Jawaban Matematika SMP 2017)
9. Paket 9 (Soal Matematika SMP 2017) + (Kunci Jawaban Matematika SMP 2017)
10. Paket 10 (Soal Matematika SMP 2017) + (Kunci Jawaban Matematika SMP 2017)
Untuk File dalam bentuk Microsoft Word, sms ke no: 087864437541 (Yoyo Apriyanto)
File akan dikirim via email
Blog Ilmu Matematika
http://ilmu-matematika.blogspot.com
Kamis, 26 Januari 2017
Kisi-Kisi UN Matematika SMP 2017
Kisi-Kisi UN Matematika SMP 2017
Blog Ilmu Matematika
http://ilmu-matematika.blogspot.com
Langganan:
Komentar (Atom)



